Reaktionsgeschwindigkeit
Entdecke die Faktoren, die die Geschwindigkeit chemischer Reaktionen beeinflussen – von Temperatur und Konzentration bis zur RGT-Regel und Stoßtheorie. Ein grundlegendes Konzept für das Verständnis chemischer Prozesse.
1. Grundlagen der Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit gibt an, wie schnell die Konzentration der Edukte abnimmt bzw. die Konzentration der Produkte zunimmt. Sie ist eine fundamentale Größe in der Chemie und entscheidend für das Verständnis von chemischen Prozessen in Natur, Technik und Alltag.
Definition der Reaktionsgeschwindigkeit:
wobei:
- \(v\) = Reaktionsgeschwindigkeit in \(\text{mol/(L·s)}\)
- \(\Delta c\) = Konzentrationsänderung in \(\text{mol/L}\)
- \(\Delta t\) = Zeitspanne in Sekunden (s)
Messung der Reaktionsgeschwindigkeit
Die Reaktionsgeschwindigkeit kann auf verschiedene Weisen gemessen werden:
- Konzentrationsänderung (spektroskopische Methoden)
- Volumenmessung bei Gasbildung
- Druckmessung bei Gasbildung/-verbrauch
- Farbänderungen und Trübungsmessungen
- Wärmemessung bei exothermen/endothermen Reaktionen
Bedeutung in der Chemie
Das Verständnis der Reaktionsgeschwindigkeit ist wichtig für:
- Industrielle Prozessoptimierung
- Entwicklung von Katalysatoren
- Biologische Prozesse (Enzymkinetik)
- Umwelt- und Atmosphärenchemie
- Materialwissenschaften und Korrosionsschutz
2. Einflussfaktoren auf die Reaktionsgeschwindigkeit
Die Geschwindigkeit einer chemischen Reaktion wird durch verschiedene Faktoren beeinflusst. Das Verständnis dieser Faktoren ermöglicht es, chemische Reaktionen gezielt zu steuern und zu optimieren.
2.1 Abhängigkeit von der Temperatur
Die Temperatur hat einen entscheidenden Einfluss auf die Reaktionsgeschwindigkeit. Mit steigender Temperatur bewegen sich die Teilchen schneller, wodurch die Anzahl der Zusammenstöße pro Zeit zunimmt. Außerdem haben mehr Teilchen genügend Energie, um die Aktivierungsenergie zu überwinden.
Experiment: Reaktion von Kalk mit Essigsäure bei unterschiedlichen Temperaturen
Material: Calciumcarbonat (\(\ce{CaCO3}\)), Essigsäure (Essig), Reagenzgläser, Wasserbad
Durchführung:
- Drei Reagenzgläser mit gleicher Menge \(\ce{CaCO3}\) befüllen
- Essigsäure auf unterschiedliche Temperaturen bringen (z.B. 5°C, 20°C, 40°C)
- Gleichzeitig die Essigsäure zu den Kalkproben geben und die Intensität der \(\ce{CO2}\)-Entwicklung beobachten
Beobachtung: Die Gasentwicklung ist bei höherer Temperatur deutlich intensiver, was auf eine schnellere Reaktion hinweist.
2.2 RGT-Regel (Reaktionsgeschwindigkeit-Temperatur-Regel)
Die RGT-Regel (auch van't-Hoff'sche Regel genannt) besagt, dass eine Temperaturerhöhung um 10°C die Reaktionsgeschwindigkeit etwa verdoppelt bis vervierfacht. Dies ist eine Faustregel, die für viele Reaktionen im Bereich von 0-40°C eine gute Näherung darstellt.
Mathematische Formulierung der RGT-Regel:
wobei:
- \(v_1, v_2\) = Reaktionsgeschwindigkeiten bei den Temperaturen \(T_1\) bzw. \(T_2\)
- \(Q_{10}\) = Temperaturkoeffizient (üblicherweise zwischen 2 und 4)
- \(T_1, T_2\) = Temperaturen in °C
2.3 Abhängigkeit von der Konzentration
Die Konzentration der Reaktanden beeinflusst direkt die Wahrscheinlichkeit von Zusammenstößen zwischen den Teilchen. Bei höheren Konzentrationen stoßen mehr Teilchen pro Zeiteinheit zusammen, was zu einer höheren Reaktionsgeschwindigkeit führt.
Experiment: Reaktion von Kalk mit Essigsäure unterschiedlicher Konzentration
Material: Calciumcarbonat (\(\ce{CaCO3}\)), Essigsäurelösungen verschiedener Konzentrationen (z.B. 5%, 10%, 20%)
Durchführung:
- Gleiche Mengen \(\ce{CaCO3}\) in drei Reagenzgläser geben
- Jeweils gleiche Volumina der verschiedenen Essigsäurekonzentrationen zugeben
- Die Intensität der \(\ce{CO2}\)-Entwicklung beobachten und vergleichen
Beobachtung: Mit zunehmender Konzentration der Essigsäure steigt die Intensität der Gasbildung, was auf eine höhere Reaktionsgeschwindigkeit hinweist.
2.4 Abhängigkeit vom Zerteilungsgrad
Der Zerteilungsgrad der Reaktanden, besonders bei Feststoffen, beeinflusst die zur Verfügung stehende Oberfläche. Eine größere Oberfläche bietet mehr Reaktionsstellen, an denen die Reaktion stattfinden kann, was zu einer höheren Reaktionsgeschwindigkeit führt.
Experiment: Reaktion von Kalk unterschiedlicher Korngröße mit Essigsäure
Material: Calciumcarbonat (\(\ce{CaCO3}\)) in verschiedenen Korngrößen (z.B. Marmorstücke, Kreide, pulverisierter Kalk), Essigsäure
Durchführung:
- Gleiche Mengen von \(\ce{CaCO3}\) verschiedener Korngrößen in separate Reagenzgläser geben
- Gleiche Mengen Essigsäure zu jeder Probe geben
- Die Intensität der \(\ce{CO2}\)-Entwicklung beobachten und vergleichen
Beobachtung: Je feiner das Kalkpulver, desto intensiver und schneller verläuft die Reaktion. Bei grobkörnigem Material ist die Reaktion langsamer und weniger intensiv.
Animation: Einfluss von Temperatur und Konzentration
Diese Animation zeigt, wie Temperatur und Konzentration die Bewegung und Kollisionsfrequenz der Teilchen beeinflussen und dadurch die Reaktionsgeschwindigkeit verändern.
3. Stoßtheorie der Reaktionsgeschwindigkeit
Die Stoßtheorie erklärt auf molekularer Ebene, warum die Reaktionsgeschwindigkeit von den oben genannten Faktoren abhängt. Sie basiert auf der Annahme, dass chemische Reaktionen durch Zusammenstöße zwischen Teilchen (Molekülen, Atomen oder Ionen) stattfinden.
Grundprinzipien der Stoßtheorie
Für eine erfolgreiche Reaktion müssen zwei Bedingungen erfüllt sein:
- Effektive Kollision: Die Teilchen müssen in der richtigen Orientierung zusammenstoßen.
- Ausreichende Energie: Die Teilchen müssen mindestens die Aktivierungsenergie (\(E_A\)) besitzen.
Die Reaktionsgeschwindigkeit ist proportional zur Anzahl der erfolgreichen Zusammenstöße pro Zeiteinheit.
Aktivierungsenergie (\(E_A\))
Die Aktivierungsenergie ist die Mindestenergie, die Teilchen benötigen, um miteinander zu reagieren:
- Sie stellt eine Energiebarriere dar, die überwunden werden muss
- Nur ein Teil der Zusammenstöße führt zur Reaktion, da nicht alle Teilchen genügend Energie haben
- Bei höherer Temperatur haben mehr Teilchen die erforderliche Energie
Energiediagramm einer chemischen Reaktion
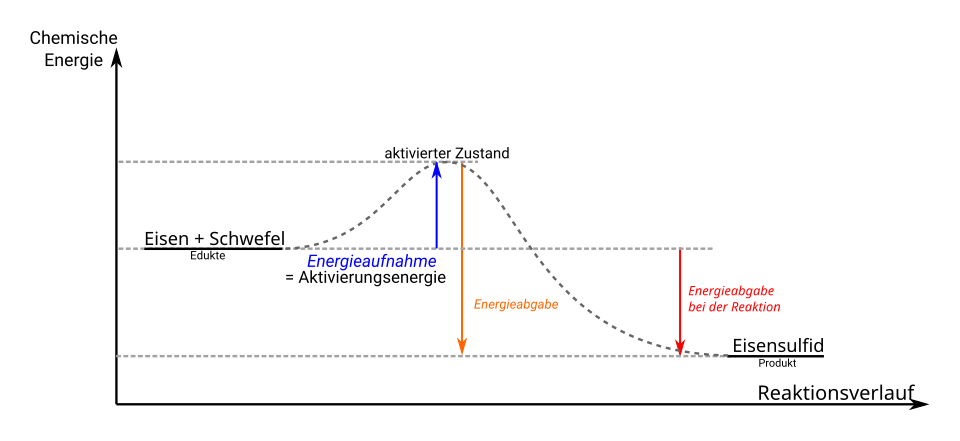
Das Energiediagramm zeigt den Verlauf der Energie während einer exothermen Reaktion. Die Aktivierungsenergie \(E_A\) ist die Energiebarriere, die überwunden werden muss, damit die Reaktion stattfinden kann. \(\Delta H\) ist die Reaktionsenthalpie.
4. Radikalische Substitution: Einfluss von Licht und Wärme
Ein spezielles Beispiel für den Einfluss von Energiezufuhr auf die Reaktionsgeschwindigkeit ist die radikalische Substitution, die bei der Reaktion von Alkanen mit Halogenen stattfindet. Diese Reaktion wird durch Licht oder Wärme initiiert.
Mechanismus der radikalischen Substitution
Die radikalische Substitution verläuft über einen Kettenmechanismus mit drei Phasen:
1. Kettenstart (Initiation)
Durch Licht- oder Wärmeenergie wird das Halogen-Molekül homolytisch gespalten:
Die entstehenden Halogenradikale sind sehr reaktiv.
2. Kettenfortpflanzung (Propagation)
a) Das Halogenradikal reagiert mit dem Alkan unter Bildung eines Alkylradikals:
b) Das Alkylradikal reagiert mit einem weiteren Halogenmolekül:
3. Kettenabbruch (Termination)
Durch Kombination von Radikalen endet die Kettenreaktion:
Die Rolle von Licht und Wärme
Sowohl Licht (insbesondere UV-Licht) als auch Wärme können die notwendige Energie für den Kettenstart liefern. Die Reaktion zwischen Methan und Chlor bei Sonnenlicht ist ein klassisches Beispiel. Die Energie wird benötigt, um die erste Bindung zu spalten und Radikale zu erzeugen.
Die Reaktionsgeschwindigkeit hängt stark von der Intensität der Energiezufuhr ab: Je intensiver das Licht oder je höher die Temperatur, desto mehr Radikale werden gebildet und desto schneller verläuft die Reaktion.
5. Qualitative Betrachtung der Reaktionsgeschwindigkeit
Neben quantitativen Messungen kann die Veränderung der Reaktionsgeschwindigkeit während einer Reaktion auch qualitativ betrachtet werden. Dies ist besonders im Schulkontext relevant, wo genaue Messgeräte oft nicht zur Verfügung stehen.
Methoden zur qualitativen Beobachtung
- Gasbildung: Beobachtung der Blasenbildung (Intensität und Häufigkeit)
- Niederschlagsbildung: Geschwindigkeit, mit der eine Trübung auftritt
- Farbänderung: Geschwindigkeit und Intensität der Farbveränderung
- Zeitliche Verfolgung: Beobachtung, wie lange es dauert, bis ein bestimmtes Stadium der Reaktion erreicht ist
Experimentelle Beobachtung: Abnahme der Reaktionsgeschwindigkeit während einer Reaktion
Material: Magnesiumband, verdünnte Salzsäure, Becherglas, Stoppuhr
Durchführung:
- Ein Stück Magnesiumband in verdünnte Salzsäure geben
- Die Intensität der Wasserstoffentwicklung über die Zeit beobachten
Beobachtung: Die Intensität der Gasbildung ist zu Beginn am stärksten und nimmt im Laufe der Reaktion ab. Dies liegt an der abnehmenden Konzentration der Reaktanden und zeigt die Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration.
6. Eigene Experimente zur Reaktionsgeschwindigkeit
Mit einfachen Mitteln kannst du selbst die Faktoren untersuchen, die die Reaktionsgeschwindigkeit beeinflussen. Hier sind einige Vorschläge für Experimente, die auch zu Hause oder in der Schule durchgeführt werden können.
Experiment 1: Temperatureinfluss
Brausetablette in Wasser
Material: Brausetabletten, Wasser (kalt, Raumtemperatur, warm), Gläser, Stoppuhr
Durchführung:
- Drei Gläser mit gleicher Menge Wasser unterschiedlicher Temperatur füllen
- Jeweils eine Brausetablette hinzugeben und die Zeit bis zur vollständigen Auflösung messen
Erwartung: In wärmerem Wasser löst sich die Tablette schneller auf.
Experiment 2: Zerteilungsgrad
Auflösung von Würfelzucker
Material: Würfelzucker, gemahlener Zucker, Wasser, Gläser, Stoppuhr
Durchführung:
- Zwei Gläser mit gleicher Menge Wasser gleicher Temperatur füllen
- In ein Glas einen Würfelzucker, in das andere die gleiche Menge gemahlenen Zucker geben
- Die Zeit bis zur vollständigen Auflösung messen
Erwartung: Der gemahlene Zucker löst sich schneller auf als der Würfelzucker.
Sicherheitshinweise für Experimente
Bei allen Experimenten mit Chemikalien sollten grundlegende Sicherheitsmaßnahmen beachtet werden:
- Schutzbrille tragen
- Schutzhandschuhe verwenden, besonders bei Säuren und Basen
- In gut belüfteten Räumen arbeiten
- Chemikalien niemals mit dem Mund aufnehmen
- Experimente mit potenziell gefährlichen Stoffen nur unter Aufsicht durchführen
7. Reaktionsgeschwindigkeit berechnen
Die Bestimmung der Reaktionsgeschwindigkeit ist ein wichtiger Teil der Chemie. Mit dem folgenden Rechner kannst du die mittlere Reaktionsgeschwindigkeit für einen bestimmten Zeitraum berechnen.
Berechnung der mittleren Reaktionsgeschwindigkeit
Berechnung der mittleren Reaktionsgeschwindigkeit:
Für ein Edukt:
Für ein Produkt:
8. Übungsaufgaben zur Reaktionsgeschwindigkeit
Übungsaufgabe 1: Berechnung der Reaktionsgeschwindigkeit
Bei einer Reaktion sinkt die Konzentration eines Edukts von 0,8 mol/L auf 0,5 mol/L innerhalb von 20 Minuten. Berechne die mittlere Reaktionsgeschwindigkeit in \(\text{mol/(L·min)}\) und in \(\text{mol/(L·s)}\).
Übungsaufgabe 2: Anwendung der RGT-Regel
Eine Reaktion hat bei 20°C eine Geschwindigkeit von 0,05 mol/(L·min). Berechne die zu erwartende Reaktionsgeschwindigkeit bei 40°C, wenn der Temperaturkoeffizient \(Q_{10} = 2{,}5\) beträgt.
Übungsaufgabe 3: Auswirkung des Zerteilungsgrads
Ein Stück Calciumcarbonat mit einer Oberfläche von 2 cm² reagiert mit Salzsäure mit einer bestimmten Geschwindigkeit. Wie ändert sich die Reaktionsgeschwindigkeit ungefähr, wenn das Calciumcarbonat so zerkleinert wird, dass die Gesamtoberfläche auf 8 cm² steigt?
9. Anwendungen in Wissenschaft und Technik
Das Verständnis der Reaktionsgeschwindigkeit und ihrer Einflussfaktoren ist in vielen Bereichen von großer Bedeutung. Hier sind einige wichtige Anwendungen:
Katalysatoren in der Industrie
Katalysatoren werden eingesetzt, um die Reaktionsgeschwindigkeit zu erhöhen, ohne selbst verbraucht zu werden:
- Haber-Bosch-Verfahren zur Ammoniakherstellung (Eisenkatalysator)
- Katalytische Reformer in Raffinerien (Platin-Katalysatoren)
- Autoabgaskatalysatoren (Platin, Palladium, Rhodium)
- Enzymatische Prozesse in der Lebensmittel- und Pharmaherstellung
Lagerstabilität und Haltbarkeit
Das Verständnis der Reaktionsgeschwindigkeit hilft bei:
- Verlängerung der Haltbarkeit von Lebensmitteln durch Kühlung
- Konservierung durch Zugabe von Antioxidantien
- Sterilisation und Pasteurisierung
- Lagerung von Chemikalien und Medikamenten
Industrielle Prozessoptimierung
In der chemischen Industrie wird die Reaktionsgeschwindigkeit durch verschiedene Parameter gesteuert:
- Optimale Temperatur für die Balance zwischen Geschwindigkeit und Selektivität
- Druck- und Konzentrationsregulierung
- Verwendung spezieller Katalysatoren
- Kontinuierliche Prozessführung mit gezielter Steuerung der Verweilzeiten
Diese Optimierungen führen zu höherer Effizienz, Energieeinsparungen und geringeren Kosten.
10. Zusammenfassung: Faktoren der Reaktionsgeschwindigkeit
| Einflussfaktor | Auswirkung auf die Reaktionsgeschwindigkeit | Erklärung (Stoßtheorie) |
|---|---|---|
| Temperatur ↑ | Geschwindigkeit ↑ | Höhere kinetische Energie, mehr Teilchen überwinden die Aktivierungsenergie |
| Konzentration ↑ | Geschwindigkeit ↑ | Mehr Teilchen pro Volumen, höhere Stoßwahrscheinlichkeit |
| Zerteilungsgrad ↑ | Geschwindigkeit ↑ | Größere Oberfläche, mehr Reaktionsstellen verfügbar |
| Druck ↑ (bei Gasen) | Geschwindigkeit ↑ | Erhöhte Teilchendichte, mehr Zusammenstöße pro Zeit |
| Katalysator | Geschwindigkeit ↑ | Alternativer Reaktionsweg mit niedrigerer Aktivierungsenergie |
| Licht/Strahlung | Geschwindigkeit ↑ | Energiezufuhr, Anregung von Elektronen, Radikalbildung |
Das Verständnis der Reaktionsgeschwindigkeit und ihrer Einflussfaktoren ist fundamental für die Chemie und hat praktische Bedeutung in zahlreichen Anwendungen. Von industriellen Prozessen bis hin zu biologischen Vorgängen – überall spielt die zeitliche Dimension chemischer Reaktionen eine wichtige Rolle.
Mit den hier vorgestellten Konzepten und Experimenten kannst du die grundlegenden Zusammenhänge selbst erforschen und nachvollziehen.